Allgemeine Chemie
Zeigt 1-12 von 65 Produkten 65 Produkte in Allgemeine Chemie
Filters
Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration (Landolt- Reaktion) -
Prinzip Bei einer chemischen Reaktion ist die Reaktionsgeschwindigkeit u.a. abhängig von Reaktionstemperatur und Konzentration der beteiligten Stoffe. Dabei ist die Konzentration der Ausgangsstoffe einer der wesentlichen Einflussgrößen auf die Reaktionsgeschwindigkeit. Allgemein gilt dabei: Je höher die Konzentration der Ausgangsstoffe ist, desto schneller läuft die entsprechende Reaktion ab. Bei einfachen Reaktionen (erster Ordnung) ist die Reaktionszeit umgekehrt proportional zur Konzentration der Ausgangsstoffe. Vorteile • Didaktisch anschauliche Einführung in die Kinetik chemischer Reaktionen • Versuchsdurchführung gemäß Richtlinien für Sicherheit im Unterricht (Gefährdungsbeurteilung verfügbar)
CHF 1’105.50
Abhängigkeit der Reaktionsgeschwindigkeit von der Temperatur (Essigsäure - Magnesium - Reaktion)
Prinzip Die Geschwindigkeit einer chemischen Reaktion wird stark von der Temperatur beeinflusst. Durch die Umsetzung von Magnesium mit Essigsäure bei verschiedenen Temperaturen und Messen der dabei jeweils pro Zeiteinheit gebildeten Mengen an Wasserstoff lässt sich dies gut zeigen. Ein Vergleich der Anfangsgeschwindigkeiten der Reaktionen zeigt in erster Näherung etwa eine Verdopplung der Reaktionsgeschwindigkeit bei einer Temperaturerhöhung um 10 K. Vorteile • Didaktisch anschauliche Einführung in die Kinetik chemischer Reaktionen • Gefährdungsbeurteilung verfügbar - einfache und schnelle Versuchsvorbereitung
CHF 4’520.95
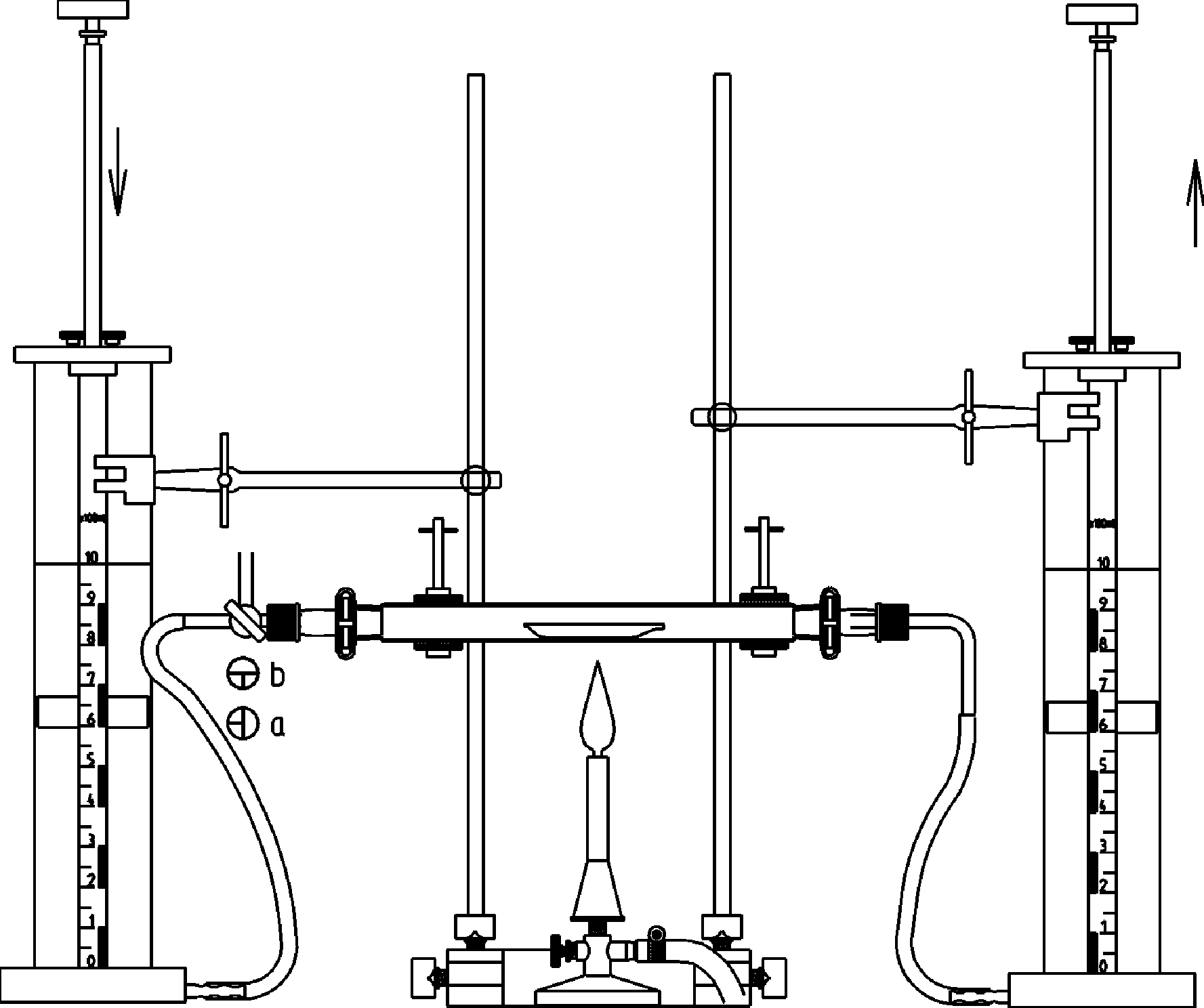
Bestimmung der molaren Masse einer Flüssigkeit
Prinzip Die molare Masse einer Flüssigkeit wird durch Verdampfen bei konstanter Temperatur und konstantem Druck ermittelt. Das Volumen des gebildeten Dampfes wird mit einer skalierten Gasspritze gemessen. Vorteile • Nutzbar als Praktikums- und Demonstrationsversuch • Einfache Versuchsdurchführung - schnelle Ergebnisse • Glasmantelsystem einfach erweiterbar
CHF 2’155.50
Bestimmung der molaren Masse unter Verwendung des idealen Gasgesetzes
Prinzip Alle Gase, ausgehend von einer ersten Annäherung, befolgen die ideale Gasgleichung, die sich auf den Druck p, das Volumen V, die Temperatur T und die Substanzmenge eines Gases n bezieht. Die Substanzmenge eines Gases n wird ausgedrückt durch die Molzahl und ist gleichzusetzen mit m/M, wobei m die Masse des Gases und M die Masse eines Mols dieses Gases ist. Das Volumen einer bekannten Gasmasse wird bei gegebener Temperatur und Druck gemessen, sodass die ideale Gasgleichung benutzt werden kann, um die molare Masse des Gases zu bestimmen. Vorteile • Untersuchung vieler verschiedener Gase möglich • anschaulicher Versuchsaufbau
CHF 5’591.55
Bestimmung des Molekulargewichtes eines Polymers durch Messung der Viskosität
Prinzip Die Viskosität einer Flüssigkeit wird durch die Stärke der intermolekularen Anziehungskräfte bestimmt. Im Falle von Lösungen kann sich die Viskosität des Lösungsmittels signifikant in Abhängigkeit von der Art und der Konzentration des gelösten Stoffes ändern. Aufgrund ihrer Größe haben Makromoleküle eine sehr beachtliche Auswirkung auf die Viskosität von Lösungsmitteln. Viskositätsmessungen können daher benutzt werden, um die durchschnittliche molekulare Masse von Makromolekülen zu bestimmen, wenn etwas über deren Konformation bekannt ist. Vorteile • Bestimmung einer wichtigen Größe der Rheologie • Nutzbar als Praktikums- und Demonstrationsversuch
CHF 2’762.25
Bestimmung molarer Massen durch Messung der Gefrierpunktserniedrigung (Kryoskopie)
Prinzip Die Lösung eines Stoffes gefriert bei einer niedrigeren Temperatur als das reine Lösungsmittel. Das Ausmaß der Erniedrigung des Gefrierpunktes ist dabei direkt proportional zur Konzentration des gelösten Stoffes. Somit kann man mit Hilfe der Gefrierpunktserniedrigung (ebenso wie mit der Siedepunktserhöhung) die Molmasse von Substanzen bestimmen. Dafür wird zuerst der Gefrierpunkt des reinen Lösungsmittels und nach Zugabe genau abgewogener Mengen der zu untersuchenden Substanz die zugehörigen Gefrierpunkte der Lösung bestimmt. Vorteile • Mit ausführlicher Versuchsbeschreibung • Kompakter, leicht transportierbarer Versuchsaufbau • Gleichzeitige Darstellung von aktueller Temperatur und Temperaturdifferenz
CHF 2’714.60
Brennbarkeit, Schmelztemperatur
Prinzip Neben den sinnlich erfassbaren Stoffeigenschaften wie beispielsweise Farbe, Glanz oder Geruch lassen sich Stoffe durch charakteristische, messbare Eigenschaften, wie z.B. Brennbarkeit und Schmelztemperatur erkennen und beschreiben. Diese Eigenschaften (Brennbarkeit und Schmelztemperatur) werden hier anhand von Eisen, Sand, Natriumchlorid, Schwefel und Naphtalin untersucht und erläutert, wie sich Stoffe aufgrund messbarer Eigenschaften einteilen lassen. Vorteile • Dieser Versuch lehrt nicht nur, wie die Stoffeigenschaften "Brennbarkeit und Schmelztemperatur" untersucht werden, sondern zeigt auch eindrucksvoll, wie sich Aggregatzustände von Stoffen beim Erhitzen ändern können. • Experimentierliteratur für Schüler und Lehrer erhältlich: Minimale Vorbereitungszeit • Gefährdungsbeurteilung für Schüler und Lehrer erhältlich • Einfaches Lehren und effizientes Lernen beim Einsatz der verfügbaren interaktiven Experimentier-Literatur
CHF 418.60
Chemischer Vorgang: Synthese und Analyse
Prinzip In ersten Versuchsteil wird die "Synthese als chemische Reaktion" näher betrachtet und dabei das Verhalten von Kupferblech im Schwefeldampf untersucht. Dazu wird in einem Reagenzglas ein Stück Schwefel erhitzt und anschließend ein Streifen Kupferblech in den Dampf gehalten. Dabei verbinden sich Kupfer und Schwefel unter Abgabe von Energie zu einem neuen Stoff.
CHF 435.90
Chromatographie
Prinzip Stoffgemische lassen sich durch Trennverfahren in ihre Bestandteile auftrennen. Ein wichtiges Trennverfahren ist die Chromatographie. In diesem Schulversuch werden Farbstoffe durch Chromatographie in einzelne Bestandteile aufgetrennt. So zeigt dieser Versuch, dass auch einfarbig erscheinende Farbstoffe in Wirklichkeit aus mehreren verschiedenfarbigen Stoffen zusammengesetzt sein können. In diesem Versuch werden Blattfarbstoffe und Filzschreiberfarbe in die Einzelstoffe aufgetrennt. Vorteile • Einfache und anschauliche Einführung in das Themengebiet (Papier)-Chromatographie (keine teuren und komplizierten Messgeräte notwendig) • Experimentierliteratur für Schüler und Lehrer erhältlich: Minimale Vorbereitungszeit • Gefährdungsbeurteilung für Schüler und Lehrer erhältlich • Einfaches Lehren und effizientes Lernen beim Einsatz der verfügbaren interaktiven Experimentier-Literatur
CHF 136.85
Chromatographische Trennverfahren: Dünnschichtchromatographie
Prinzip Chromatographische Trennverfahren sind für die analytische Chemie sehr wichtig. Ihre relativ einfache Technik und die Möglichkeit, selbst die kleinsten Mischungsanteile zu trennen, erklären die rasche Entwicklung dieser Prozesse. Es gibt zahlreiche Variationen dieser Methode. Als Ergebnis kann das optimale chromatographische Trennverfahren für nahezu jede Trennaufgabe gefunden werden. Das hier beschriebene Verfahren kann dazu verwendet werden, die Grundprinzipien und Möglichkeiten dieses Verfahrens mit relativ einfachen Mitteln zu demonstrieren. Aufgaben Trennen Sie eine Farbstoffmischung durch Dünnschichtchromatographie. Lernziele • Dünnschichtchromatographie • Trennverfahren • Adsorbierendes Material • Stationäre Phase • Mobile Phase • Kapillarwirkung Vorteile • Didaktischer Einstieg in ein grundlegendes Trennverfahren
CHF 805.65
Das Gesetz der festen Massenverhältnisse bei chemischen Reaktionen - quantitative Untersuchungen zu Oxiden und Sulfiden
Prinzip Das Gesetz der festen Massenverhältnisse lautet: "Chemische Verbindungen setzen sich aus den Elementen nach festen Massenverhältnissen zusammen. Entdecker dieses Gesetzes war Joseph Louis Proust (1754-1826). Der Nachweis dieses Gesetzes wird im ersten Versuch durch quantitative Verfolgung der Synthese von Metallsulfiden, im zweiten und dritten Versuch dagegen durch Reduktionen von Metalloxiden geführt. Vorteile • Experimentierliteratur für Schüler und Lehrer erhältlich: Minimale Vorbereitungszeit • Gefährdungsbeurteilung für Schüler und Lehrer erhältlich • Einfaches Lehren und effizientes Lernen beim Einsatz der verfügbaren interaktiven Experimentier-Literatur
CHF 7’595.90
Das Verhalten von Salzen gegenüber unterschiedlich polaren Lösungsmitteln
Prinzip Salze lösen sich in polaren Lösungsmitteln wesentlich besser als in unpolaren Lösungsmitteln. Liegen zwei unterschiedlich polare Lösungsmittel vor, können Salze aus der unpolaren Phase in die polare wechseln und sich dort lösen. Vorteile • Experimentierliteratur für Schüler und Lehrer erhältlich: Minimale Vorbereitungszeit • Gefährdungsbeurteilung für Schüler und Lehrer erhältlich • Einfaches Lehren und effizientes Lernen beim Einsatz der verfügbaren interaktiven Experimentier-Literatur
CHF 261.15

























 Versuche & Sets
Versuche & Sets