Allgemeine Chemie
Zeigt 1-10 von 10 Produkten 10 Produkte in Allgemeine Chemie
Filters
Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration (Landolt- Reaktion) -
Prinzip Bei einer chemischen Reaktion ist die Reaktionsgeschwindigkeit u.a. abhängig von Reaktionstemperatur und Konzentration der beteiligten Stoffe. Dabei ist die Konzentration der Ausgangsstoffe einer der wesentlichen Einflussgrößen auf die Reaktionsgeschwindigkeit. Allgemein gilt dabei: Je höher die Konzentration der Ausgangsstoffe ist, desto schneller läuft die entsprechende Reaktion ab. Bei einfachen Reaktionen (erster Ordnung) ist die Reaktionszeit umgekehrt proportional zur Konzentration der Ausgangsstoffe. Vorteile • Didaktisch anschauliche Einführung in die Kinetik chemischer Reaktionen • Versuchsdurchführung gemäß Richtlinien für Sicherheit im Unterricht (Gefährdungsbeurteilung verfügbar)
CHF 1’105.50
Abhängigkeit der Reaktionsgeschwindigkeit von der Temperatur (Essigsäure - Magnesium - Reaktion)
Prinzip Die Geschwindigkeit einer chemischen Reaktion wird stark von der Temperatur beeinflusst. Durch die Umsetzung von Magnesium mit Essigsäure bei verschiedenen Temperaturen und Messen der dabei jeweils pro Zeiteinheit gebildeten Mengen an Wasserstoff lässt sich dies gut zeigen. Ein Vergleich der Anfangsgeschwindigkeiten der Reaktionen zeigt in erster Näherung etwa eine Verdopplung der Reaktionsgeschwindigkeit bei einer Temperaturerhöhung um 10 K. Vorteile • Didaktisch anschauliche Einführung in die Kinetik chemischer Reaktionen • Gefährdungsbeurteilung verfügbar - einfache und schnelle Versuchsvorbereitung
CHF 4’520.95
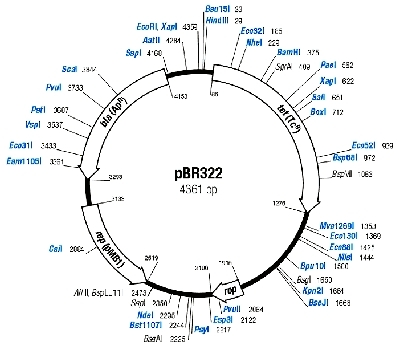
Bakterielle Plasmid-DNA in der Gel-Elektrophorese mit blueGel Elektrophoresekammer
Prinzip Die am häufigsten verwendete Arbeitsmethode in der Molekulargenetik wird in diesem Experiment durchgeführt. Mit Hilfe der Agarose-Gelelektrophorese werden Wanderungsgeschwindigkeit von Plasmid-DNA-Molekülen und das Bandenmuster der durch Restriktionsenzyme verdauter Plasmid-DNA im Agarosegel untersucht. Vorteile • Komplettausstattung inkl. der benötigten Verbrauchsmaterialien • Verbrauchsmaterialien können separat als Kit nachgekauft werden • Gebrauchsfertig: die DNA-Proben können direkt in der Elektrophorese eingesetzt werden • Gut dokumentierter, einfacher Versuchsablauf • DNA-Proben müssen nicht kühl gelagert werden, da sie lyophilisiert sind
CHF 1’742.-
Bestimmung der molaren Masse unter Verwendung des idealen Gasgesetzes
Prinzip Alle Gase, ausgehend von einer ersten Annäherung, befolgen die ideale Gasgleichung, die sich auf den Druck p, das Volumen V, die Temperatur T und die Substanzmenge eines Gases n bezieht. Die Substanzmenge eines Gases n wird ausgedrückt durch die Molzahl und ist gleichzusetzen mit m/M, wobei m die Masse des Gases und M die Masse eines Mols dieses Gases ist. Das Volumen einer bekannten Gasmasse wird bei gegebener Temperatur und Druck gemessen, sodass die ideale Gasgleichung benutzt werden kann, um die molare Masse des Gases zu bestimmen. Vorteile • Untersuchung vieler verschiedener Gase möglich • anschaulicher Versuchsaufbau
CHF 5’591.55
Bestimmung des Molekulargewichtes eines Polymers durch Messung der Viskosität
Prinzip Die Viskosität einer Flüssigkeit wird durch die Stärke der intermolekularen Anziehungskräfte bestimmt. Im Falle von Lösungen kann sich die Viskosität des Lösungsmittels signifikant in Abhängigkeit von der Art und der Konzentration des gelösten Stoffes ändern. Aufgrund ihrer Größe haben Makromoleküle eine sehr beachtliche Auswirkung auf die Viskosität von Lösungsmitteln. Viskositätsmessungen können daher benutzt werden, um die durchschnittliche molekulare Masse von Makromolekülen zu bestimmen, wenn etwas über deren Konformation bekannt ist. Vorteile • Bestimmung einer wichtigen Größe der Rheologie • Nutzbar als Praktikums- und Demonstrationsversuch
CHF 2’762.25
Chemischer Vorgang: Synthese und Analyse
Prinzip In ersten Versuchsteil wird die "Synthese als chemische Reaktion" näher betrachtet und dabei das Verhalten von Kupferblech im Schwefeldampf untersucht. Dazu wird in einem Reagenzglas ein Stück Schwefel erhitzt und anschließend ein Streifen Kupferblech in den Dampf gehalten. Dabei verbinden sich Kupfer und Schwefel unter Abgabe von Energie zu einem neuen Stoff.
CHF 435.90
Das Gesetz der festen Massenverhältnisse bei chemischen Reaktionen - quantitative Untersuchungen zu Oxiden und Sulfiden
Prinzip Das Gesetz der festen Massenverhältnisse lautet: "Chemische Verbindungen setzen sich aus den Elementen nach festen Massenverhältnissen zusammen. Entdecker dieses Gesetzes war Joseph Louis Proust (1754-1826). Der Nachweis dieses Gesetzes wird im ersten Versuch durch quantitative Verfolgung der Synthese von Metallsulfiden, im zweiten und dritten Versuch dagegen durch Reduktionen von Metalloxiden geführt. Vorteile • Experimentierliteratur für Schüler und Lehrer erhältlich: Minimale Vorbereitungszeit • Gefährdungsbeurteilung für Schüler und Lehrer erhältlich • Einfaches Lehren und effizientes Lernen beim Einsatz der verfügbaren interaktiven Experimentier-Literatur
CHF 7’595.90
Dissoziationsgleichgewicht mit Cobra SMARTsense
Prinzip Carbonsäuren sind potentielle Elektrolyte, die in wässriger Lösung schwach dissoziiert vorliegen. Die Lage des Dissoziationsgleichgewichts wird quantitativ durch den Ks bzw. pKs-Wert beschrieben, der über potentiometrische Messungen ermittelt werden kann. Vorteile • Voreinstellungen für den Versuch sparen Zeit und verhindern Fehler • Tropfenzähler optimiert die Versuchsdurchführung
CHF 2’431.40
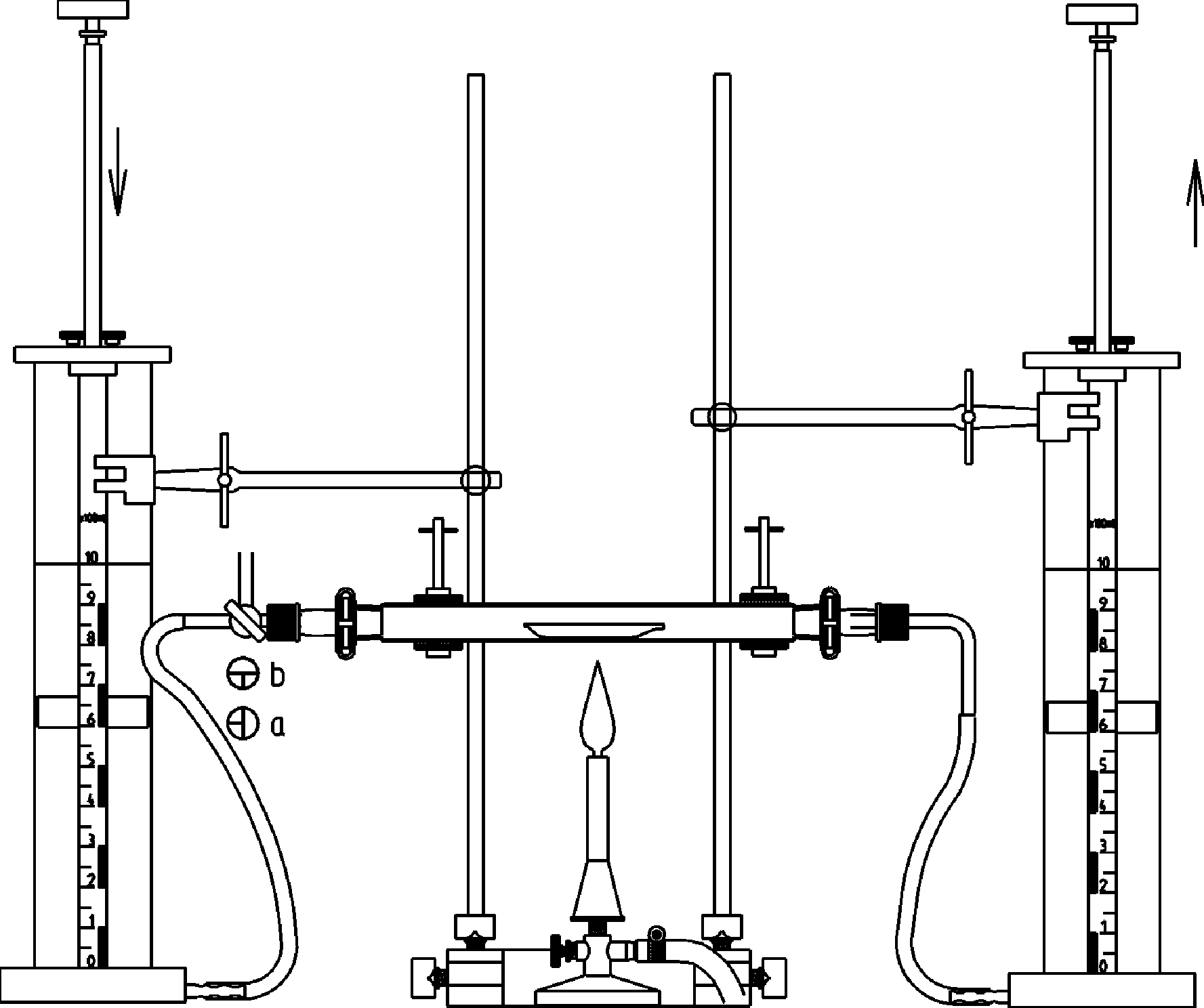
Reaktionsgeschwindigkeit und Aktivierungsenergie für die saure Hydrolyse von Essigsäureethylester
Prinzip Essigsäureethylester wird in saurer Lösung nach einem Zeitgesetz pseudo-erster Ordnung zu äquivalenten Mengen an Ethanol und Essigsäure hydrolysiert. Durch alkalimetrische Bestimmung der gebildeten Essigsäure kann auf die zeitliche Konzentration an Ester geschlossen werden. Vorteile • Thermostat für präzise Temperaturkontrolle • Stabiler und sicherer Aufbau durch solides Stativmaterial
CHF 3’488.65
Verteilungsgleichgewicht
Prinzip Bei konstanter Temperatur und konstantem Druck verteilt sich eine gelöste Substanz zwischen zwei mischbaren Flüssigkeiten in einem konstanten Konzentrationsverhältnis. Dieses Verhältnis entspricht dem Verteilungskoeffizienten (Distributionskoeffizient) der untersuchten Substanz in dem gegebenen Zweiphasensystem. Vorteile • Modernes, einfach zu bedienendes Fotospektrometer
CHF 2’769.10

























 Versuche & Sets
Versuche & Sets