Lehrerversuche
Zeigt 1-4 von 4 Produkten 4 Produkte in Lehrerversuche
Filters
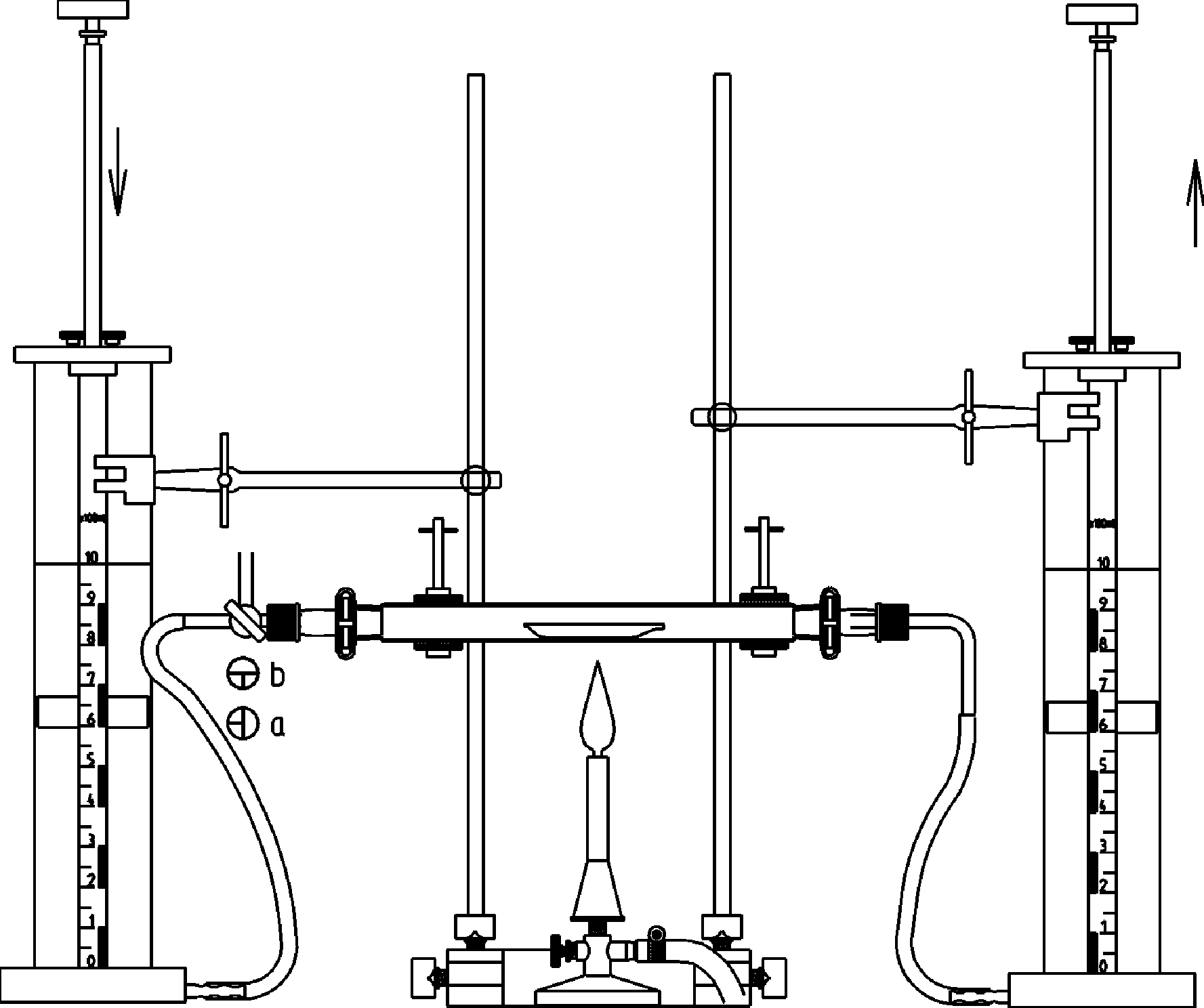
Bestimmung der molaren Massen von Metallen
Prinzip Die molare Masse [M] bildet sich aus dem Quotienten der Masse [m] und der Stoffmenge [n] eines Stoffes (M=m/n) und wird üblicherweise in g/mol angegeben. Im Versuche wird in den Einsatz des Reaktionszylinders ein abgewogenes Stück Metall gegeben und der Zylinder über den Dreiwegehahn mit einer Säure etwa bis zur Hälfte gefüllt. Durch Absenken des Einsatzes bringt man das Metall mit der Säure zur Reaktion und fängt den entstehenden Wasserstoff in der angeschlossenen Gasspritze auf. Aus der Masse des Metalls und dem Volumen des entstandenen Wasserstoffs erhält man die gesuchte Molmasse. Die Reaktion kann auch dazu genutzt werden, die Wertigkeit des Metalls zu bestimmen. Vorteile • Schnelle und einfache Versuchsvorbereitung (Versuchsanleitung und Gefährdungsbeurteilung verfügbar) • Übersichtlicher Aufbau auf der Hafttafel und anschauliche Versuchsdurchführung • Versuchsaufbau auch zur Bestimmungung der Molmasse weiterer Metalle geeignet
CHF 1’796.60
Das Gesetz der festen Massenverhältnisse bei chemischen Reaktionen - quantitative Untersuchungen zu Oxiden und Sulfiden
Prinzip Das Gesetz der festen Massenverhältnisse lautet: "Chemische Verbindungen setzen sich aus den Elementen nach festen Massenverhältnissen zusammen. Entdecker dieses Gesetzes war Joseph Louis Proust (1754-1826). Der Nachweis dieses Gesetzes wird im ersten Versuch durch quantitative Verfolgung der Synthese von Metallsulfiden, im zweiten und dritten Versuch dagegen durch Reduktionen von Metalloxiden geführt. Vorteile • Experimentierliteratur für Schüler und Lehrer erhältlich: Minimale Vorbereitungszeit • Gefährdungsbeurteilung für Schüler und Lehrer erhältlich • Einfaches Lehren und effizientes Lernen beim Einsatz der verfügbaren interaktiven Experimentier-Literatur
CHF 7’595.90
Das Gesetz von der Erhaltung der Masse bei chemischen Reaktionen
Prinzip Die experimentelle Bestätigung des Gesetzes vom Erhalt der Masse kann durch die Fällung von Calciumcarbonat im Gefäß nach Landolt erfolgen. Die beiden Lösungen mit den Ausgangsprodukten werden getrennt voneinander in die beiden Schenkel des Gefäßes eingefüllt, das Gefäß wird verschlossen und gewogen. Durch Kippen des Gefäßes werden die Lösungen gemischt und eine Fällungsreaktion kann beobachtet werden. Dabei kommt es zu keiner Veränderung der Masse, wie sich durch erneutes Wägen leicht feststellen lässt. Vorteile • Didaktisch anschauliche Einführung in das Prinzip der Massenerhaltung bei chemischen Reaktionen • Experimentierliteratur für Schüler und Lehrer erhältlich: Minimale Vorbereitungszeit • Gefährdungsbeurteilung für Schüler und Lehrer erhältlich • Einfaches Lehren und effizientes Lernen beim Einsatz der verfügbaren interaktiven Experimentier-Literatur
CHF 8’576.90
Verteilungsgleichgewicht
Prinzip Bei konstanter Temperatur und konstantem Druck verteilt sich eine gelöste Substanz zwischen zwei mischbaren Flüssigkeiten in einem konstanten Konzentrationsverhältnis. Dieses Verhältnis entspricht dem Verteilungskoeffizienten (Distributionskoeffizient) der untersuchten Substanz in dem gegebenen Zweiphasensystem. Vorteile • Modernes, einfach zu bedienendes Fotospektrometer
CHF 2’769.10


















 Versuche & Sets
Versuche & Sets