Lehrerversuche
Zeigt 1-12 von 436 Produkten 436 Produkte in Lehrerversuche
Filters
4-Punkt-Methode / Messung kleiner Widerstände und Ohmsches Gesetz
Prinzip Die Widerstände der verschiedenen Gleichstrom-Leitungen werden durch Aufzeichnung der Strom-Spannungs-Kennlinie bestimmt. Der Widerstand von Metallstangen und der Kontaktwiderstand Anschlusskabel wird berechnet.
CHF 2’475.85
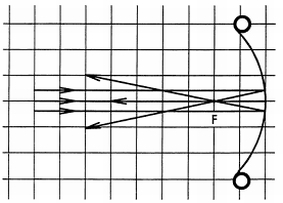
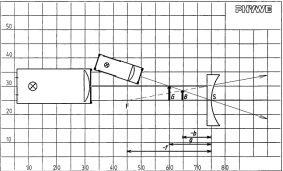
Abbildungsfehler am Hohlspiegel (Katakaustik)
Prinzip Abbildungen am Hohlspiegel werden unscharf bzw. verzerrt, wenn der Gegenstand im Verhältnis zum Krümmungsradius des Spiegels relativ groß ist. Vorteile • minimale Vorbereitungszeit • lichtstarke Halogenleuchte • einfaches Lehren durch Einsatz der Demo-Tafel Physik • ideale Ergänzung zu analogen Schülerversuchen durch direkt vergleichbare Geräte
CHF 2’018.60
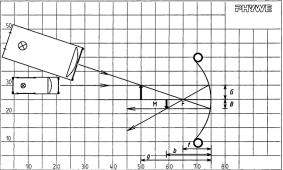
Abbildungsgesetz und Abbildungsmaßstab für den Hohlspiegel
Prinzip Auch für den Hohlspiegel gelten das Abbildungsgesetz: 1/f = 1/g + 1/b sowie das Abbildungsgesetz: B/G = b/g . Vorteile • minimale Vorbereitungszeit • lichtstarke Halogenleuchte • einfaches Lehren durch Einsatz der Demo-Tafel Physik • ideale Ergänzung zu analogen Schülerversuchen durch direkt vergleichbare Geräte
CHF 2’091.10
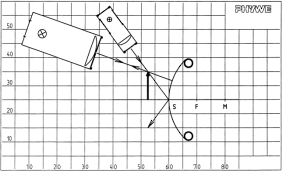
Abbildungsgesetz und Abbildungsmaßstab für den Wölbspiegel
Vorteile • minimale Vorbereitungszeit • lichtstarke Halogenleuchte • einfaches Lehren durch Einsatz der Demo-Tafel Physik • ideale Ergänzung zu analogen Schülerversuchen durch direkt vergleichbare Geräte
CHF 2’091.10
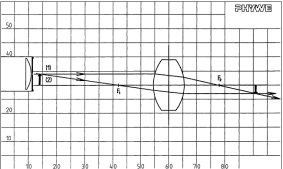
Abbildungsgesetz und Abbildungsmaßstab für die Sammellinse
Vorteile • minimale Vorbereitungszeit • lichtstarke Halogenleuchte • einfaches Lehren durch Einsatz der Demo-Tafel Physik • ideale Ergänzung zu analogen Schülerversuchen durch direkt vergleichbare Geräte
CHF 2’081.10
Abbildungsgesetz und Abbildungsmaßstab für eine Zerstreuungslinse
Vorteile • minimale Vorbereitungszeit • lichtstarke Halogenleuchte • einfaches Lehren durch Einsatz der Demo-Tafel Physik • ideale Ergänzung zu analogen Schülerversuchen durch direkt vergleichbare Geräte
CHF 2’116.65
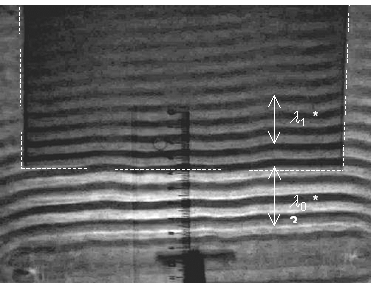
Abhängigkeit der Ausbreitungsgeschwindigkeit von der Wassertiefe
Vorteile • Reflexionsfreie Wellenwanne auf justierbaren Stellfüßen mit 3-Punkt Justage • Amplituden- und frequenzvariables Erregersystem • Stroboskop zur synchronen oder "slow-motion"-Darstellung der Wellen • Gleichzeitige LED-Anzeige von: Frequenz, Amplitude, Phasenverschiebung und Beleuchtungsart • Die Steuerung aller Parameter findet über das auf der Oberseite befindliche Tastenfeld statt • Projektion auf transparenten Arbeitstisch zur verzerrungsfreien Abbildung des Wellenbildes • Grüne Hochleistungs-LED für brilliante Bildwiedergabe • Einfache Auswertung des Wellenbildes im Praktikum auch durch einfaches Auflegen eines Blattes auf den Tisch möglich
CHF 2’535.75
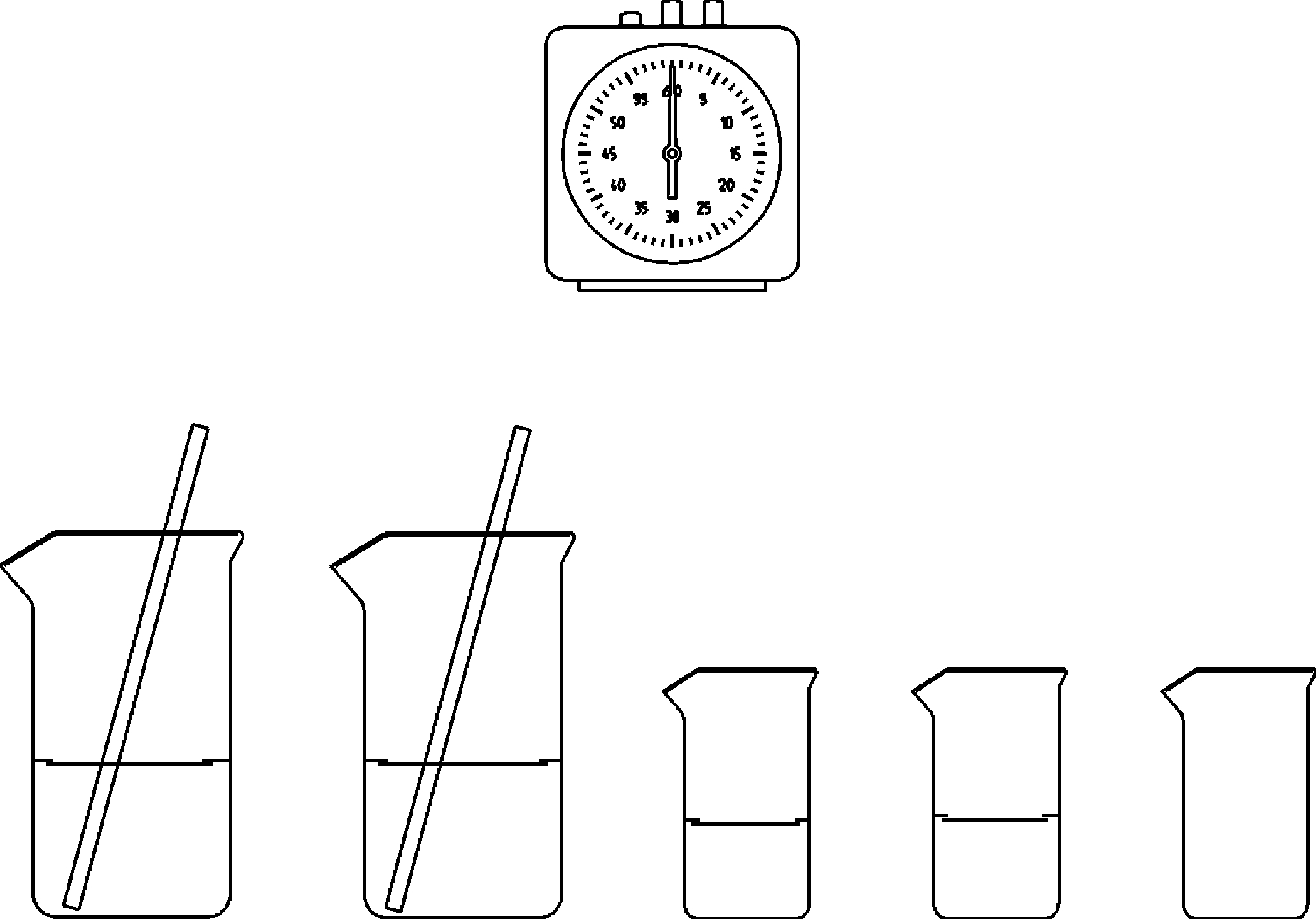
Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration (Landolt- Reaktion) -
Prinzip Bei einer chemischen Reaktion ist die Reaktionsgeschwindigkeit u.a. abhängig von Reaktionstemperatur und Konzentration der beteiligten Stoffe. Dabei ist die Konzentration der Ausgangsstoffe einer der wesentlichen Einflussgrößen auf die Reaktionsgeschwindigkeit. Allgemein gilt dabei: Je höher die Konzentration der Ausgangsstoffe ist, desto schneller läuft die entsprechende Reaktion ab. Bei einfachen Reaktionen (erster Ordnung) ist die Reaktionszeit umgekehrt proportional zur Konzentration der Ausgangsstoffe. Vorteile • Didaktisch anschauliche Einführung in die Kinetik chemischer Reaktionen • Versuchsdurchführung gemäß Richtlinien für Sicherheit im Unterricht (Gefährdungsbeurteilung verfügbar)
CHF 1’105.50
Abhängigkeit der Reaktionsgeschwindigkeit von der Stoffart
Prinzip Nach den fundamentalen Gesetzen der Chemie läuft eine chemische Reaktion dann spontan ab, wenn sie exotherm ist, d.h. Energie (meist in Form von Wärme) an die Umgebung abgibt. Die Reaktionsgeschwindigkeit einer Reaktion ist dabei abhängig von der Reaktionstemperatur und die Konzentration der Ausgangsstoffe (eine Erhöhung der Reaktionstemperatur bzw. der Konzentration der Ausgangsstoffe führt zu einer Erhöhung der Reaktionsgeschwindigkeit). Dieser Versuch soll zeigen, dass bei gleicher Temperatur, gleicher Konzentration und vergleichbarer Oberfläche der Ausgangsstoffe trotzdem ein Unterschied in der Reaktionsgeschwindigkeit bei vergleichbaren "Reaktionsmechanismen" beobachtbar ist. Dazu wird Magnesium bzw. Zink mit konzentrierter Salzsäure zur Reaktion gebracht und die entstandene Menge an Wasserstoff untersucht. Beide Reaktionen laufen nach dem gleichen Schema ab ("Metall + Säure -> Salz + Wasserstoff") und dennoch wird eine unterschiedliche Reaktionsgeschwindigkeit beider Reaktionen beobachtet (anhand der Menge an gebildeten Wasserstoff). Obwohl die Reaktionstemperatur, Ausgangskonzentration und Oberfläche der Ausgangsstoffe in etwas gleich ist, läuft die Umsetzung von Magnesium mit Salzsäure deutlich schneller ab. Aufgrund der Stellung in der elektrochemischen Reihe der Elemente hat Magnesium gegenüber Wasserstoff ein wesentlich negativeres Potential als Zink. Dadurch reagiert Magnesium heftiger, d. h. schneller mit Salzsäure reagieren als Zink. Vorteile • Anschauliche Einführung in Kinetik chemischer Reaktionen • Versuchsdurchführung gemäß den Richtlinien für Sicherheit im Unterricht (Gefährdungsbeurteilung verfügbar)
CHF 4’131.20
Abhängigkeit der Reaktionsgeschwindigkeit von der Temperatur (Essigsäure - Magnesium - Reaktion)
Prinzip Die Geschwindigkeit einer chemischen Reaktion wird stark von der Temperatur beeinflusst. Durch die Umsetzung von Magnesium mit Essigsäure bei verschiedenen Temperaturen und Messen der dabei jeweils pro Zeiteinheit gebildeten Mengen an Wasserstoff lässt sich dies gut zeigen. Ein Vergleich der Anfangsgeschwindigkeiten der Reaktionen zeigt in erster Näherung etwa eine Verdopplung der Reaktionsgeschwindigkeit bei einer Temperaturerhöhung um 10 K. Vorteile • Didaktisch anschauliche Einführung in die Kinetik chemischer Reaktionen • Gefährdungsbeurteilung verfügbar - einfache und schnelle Versuchsvorbereitung
CHF 4’520.95

























 Versuche & Sets
Versuche & Sets