Einfache qualitative Nachweise
Zeigt 1-8 von 8 Produkten 8 Produkte in Einfache qualitative Nachweise
Filters
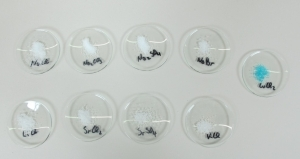
Anionen-Nachweis durch Fällungsreaktionen
Prinzip Durch Fällungsreaktionen ist es möglich, einzelne Bestandteile einer Lösung nachzuweisen. Wichtig ist das z.B. im Laboralltag für den Nachweis von geringen Ionenkonzentrationen. Auch im Alltag sind Fällungsreaktionen wichtig, in Kläranlagen werden diese verwendet um störende Ionen zu entfernen. In diesem Schülerversuch werden die Anionen "Chlorid", "Bormid", "Sulfat" und "Carbonat" durch entsprechende Reaktionen mit einem Nachweisreagenz nachgewiesen. Vorteile • Experimentierliteratur für Schüler und Lehrer erhältlich: Minimale Vorbereitungszeit • Gefährdungsbeurteilung für Schüler und Lehrer erhältlich • Einfaches Lehren und effizientes Lernen beim Einsatz der verfügbaren interaktiven Experimentier-Literatur
CHF 245.40
Eigenschaften von Lithium, Natrium und Kalium
Prinzip In diesem Versuch wird das Verhalten der Alkalimetalle an der Luft, sowie die Flammenfärbung bei deren Verbrennung untersucht. Die Reaktionsprodukte werden in Wasser gelöst, wobei der pH-Wert mit Hilfe des Indikators Phenolphtalein abgeschätzt wird. Abschließend wird die elektrische Leitfähigkeit der Alkalimetalle untersucht. Vorteile • Experimentierliteratur für Schüler und Lehrer erhältlich: Minimale Vorbereitungszeit • Gefährdungsbeurteilung für Schüler und Lehrer erhältlich • Einfaches Lehren und effizientes Lernen beim Einsatz der verfügbaren interaktiven Experimentier-Literatur
CHF 2’239.20
Kationennachweis durch Flammenfärbung
Prinzip Viele Metallsalze geben in zunächst farbloser Flamme Farben unterschiedlicher Wellenlänge ab. Diese Flammenfärbung ist für die einzelnen Metall-Kationen charakteristisch und kann zu deren Identifizierung eingesetzt werden. In der Praxis findet dies Anwendung bei spektroskopischen Untersuchungen entsprechender Verbindungen. Vorteile • Experimentierliteratur für Schüler und Lehrer erhältlich: Minimale Vorbereitungszeit • Gefährdungsbeurteilung für Schüler und Lehrer erhältlich • Einfaches Lehren und effizientes Lernen beim Einsatz der verfügbaren interaktiven Experimentier-Literatur
CHF 336.20
Nachweis von Sauerstoff
Prinzip Für den Nachweis von Sauerstoff gibt es unterschiedliche Methoden. Eine einfache und sehr schnelle Nachweisprobe des in einer Reaktion entstehenden Sauerstoffes ist die sogenannte Glimmspanprobe. Diese Nachweismethode wird in diesem Schülerversuch mittels Glimmspanprobe durchgeführt. Dazu wird etwas Kaliumpermanganat in einem Reagenzglas erhitzt und ein noch glühender Holzspan in das Reagenzglas eingeführt. Das Wiederaufflammen des Spans (Glimmspanprobe) identifiziert den entstandenen Sauerstoff. Vorteile • Experimentierliteratur für Schüler und Lehrer erhältlich: Minimale Vorbereitungszeit • Gefährdungsbeurteilung für Schüler und Lehrer erhältlich • Einfaches Lehren und effizientes Lernen beim Einsatz der verfügbaren interaktiven Experimentier-Literatur
CHF 226.-
Nachweis von Stickstoff
Prinzip Für den Nachweis von Stickstoff gibt es unterschiedliche Methoden, die meisten sind aber zeitaufwändig und sehr teuer in der Durchführung. Eine einfache Methode zur Bestimmung von Stickstoff beruht darauf, den Stickstoff als Ammoniak durch eine Geruchsprobe nachzuweisen. Vorteile • Experimentierliteratur für Schüler und Lehrer erhältlich: Minimale Vorbereitungszeit • Gefährdungsbeurteilung für Schüler und Lehrer erhältlich • Einfaches Lehren und effizientes Lernen beim Einsatz der verfügbaren interaktiven Experimentier-Literatur
CHF 211.70
Nachweis von Wasserstoff
Prinzip Für den Nachweis von Wasserstoff gibt es unterschiedliche Methoden. Eine einfache und sehr schnelle Nachweisprobe des in einer Reaktion entstehenden Wasserstoff ist die sogenannte Knallgasprobe. Diese Nachweismethode wird in diesem Schülerversuch mittels Knallgasprobe durchgeführt. Dazu wird ein Stück Zinkblech in ein mit Salzsäure gefülltes Reagenzglas gegeben. Das sich entwickelnde Gas wird mit Hilfe eines zweiten Reagenzglases, das mit der Öffnung über das erste gestülpt wird, aufgefangen. Das mit Gas gefüllte Reagenzglas wird dann an die Brennerflamme gehalten (Knallgasprobe). Vorteile • Experimentierliteratur für Schüler und Lehrer erhältlich: Minimale Vorbereitungszeit • Gefährdungsbeurteilung für Schüler und Lehrer erhältlich • Einfaches Lehren und effizientes Lernen beim Einsatz der verfügbaren interaktiven Experimentier-Literatur
CHF 192.20
Salzbildung durch Fällungsreaktion - Anionennachweise Chlorid und Sulfat
Prinzip Salze in Form wässriger Lösungen können mit anderen Salzen reagieren, wobei ein Austausch von Anionen oder Kationen stattfindet. Die Bildung des neuen Salzes wird sichtbar, wenn dieses als unlösliche Komponente aus der wässrigen Lösung ausfällt. Vorteile • Versuch ist Teil einer Komplettlösung mit zahlreichen Versuchen aus dem Bereich Anorganische Chemie - Salze, einfacher Aufbau einer Unterrichtsreihe • Experimentierliteratur für Schüler und Lehrer erhältlich: Minimale Vorbereitungszeit • Gefährdungsbeurteilung für Schüler und Lehrer erhältlich • Einfaches Lehren und effizientes Lernen beim Einsatz der verfügbaren interaktiven Experimentier-Literatur
CHF 231.70
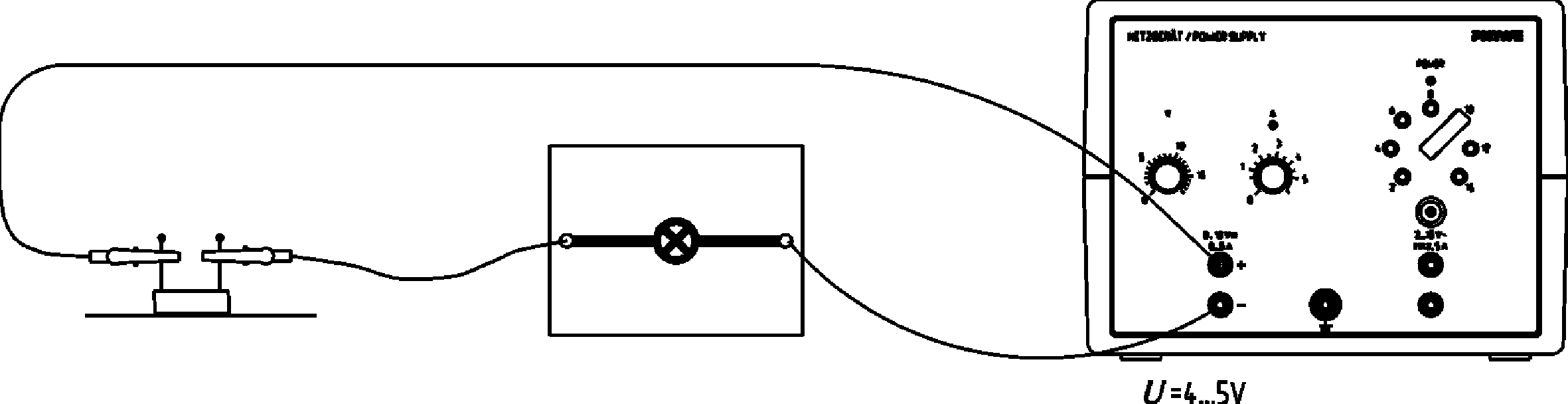
Veränderung der Spannung einer Konzentrationskette durch Fällung oder Komplexierung
Prinzip In Konzentrationsketten ist die Spannung umso höher, je weiter die Konzentrationen der Lösungen in den Halbzellen voneinander abweichen. An einer Konzentrationskette aus zwei absolut gleichen Halbzellen, z.B. Kupferelektroden in 0,1 molarer Kupfersulfatlösung, ist keine Spannung messbar. Gibt man dann aber zu der Lösung einer der Halbzellen Ionen, die mit dem wirksamen Metallion der Lösung (z.B. Cu2+) eine schwerlösliche Verbindung eingehen (z.B. Iodidionen, die mit Cu2+ unter Bildung von schwerlöslichem Kupfer(I)-iodid reagieren), so fällt ein Teil der Metallionen durch Niederschlag aus. Vorteile • Versuch ist Teil einer Komplettsets, mit der alle wichtigen curricularen Themen der Elektrochemie abgedeckt werden • Schnelle und einfache Versuchsvorbereitung (Versuchsanleitung und Gefährdungsbeurteilung verfügbar)
CHF 198.05

























 Versuche & Sets
Versuche & Sets