Chemische Reaktionen
Zeigt 1-10 von 10 Produkten 10 Produkte in Chemische Reaktionen
Filters
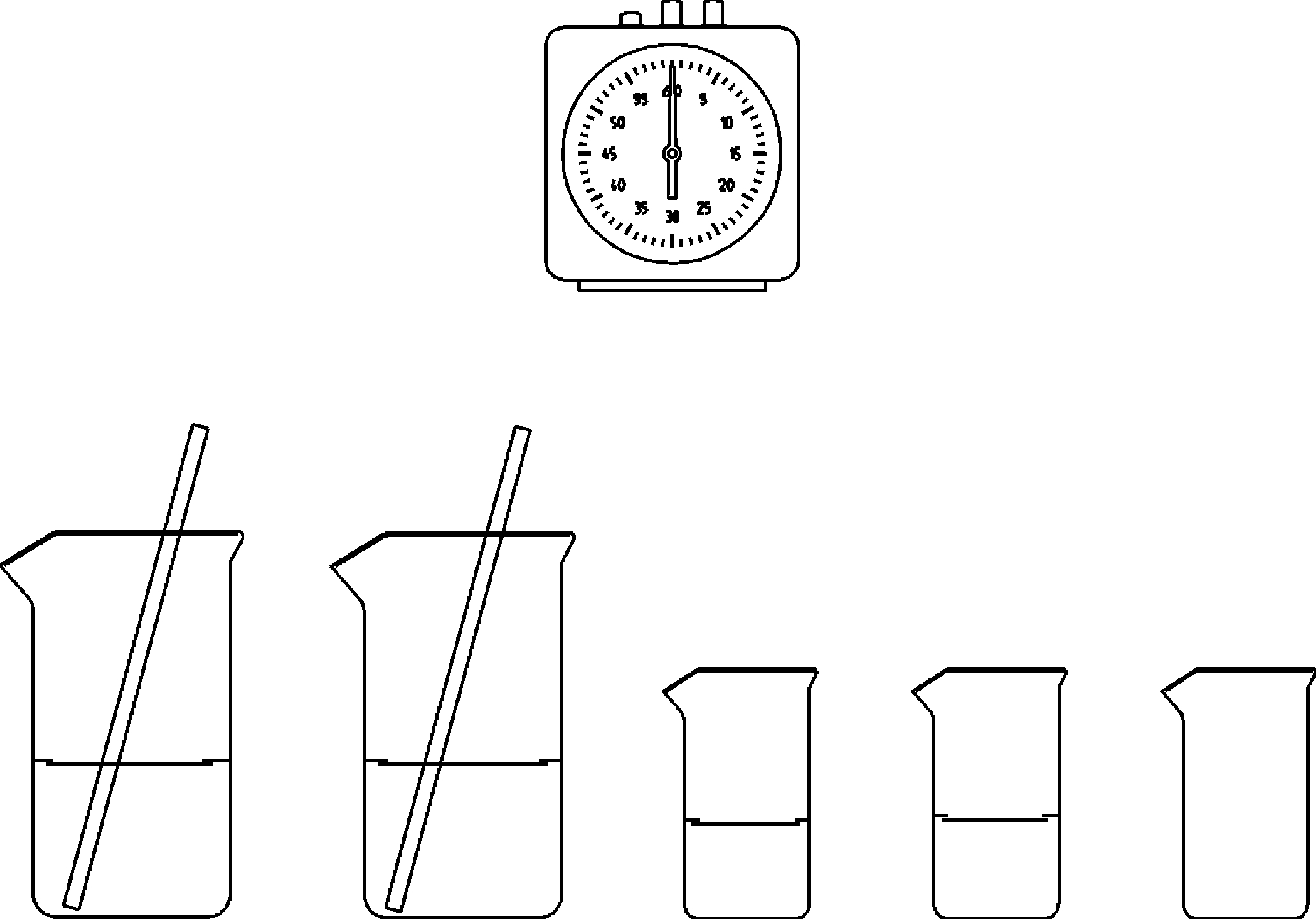
Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration (Landolt- Reaktion) -
Prinzip Bei einer chemischen Reaktion ist die Reaktionsgeschwindigkeit u.a. abhängig von Reaktionstemperatur und Konzentration der beteiligten Stoffe. Dabei ist die Konzentration der Ausgangsstoffe einer der wesentlichen Einflussgrößen auf die Reaktionsgeschwindigkeit. Allgemein gilt dabei: Je höher die Konzentration der Ausgangsstoffe ist, desto schneller läuft die entsprechende Reaktion ab. Bei einfachen Reaktionen (erster Ordnung) ist die Reaktionszeit umgekehrt proportional zur Konzentration der Ausgangsstoffe. Vorteile • Didaktisch anschauliche Einführung in die Kinetik chemischer Reaktionen • Versuchsdurchführung gemäß Richtlinien für Sicherheit im Unterricht (Gefährdungsbeurteilung verfügbar)
CHF 1’105.50
Abhängigkeit der Reaktionsgeschwindigkeit von der Temperatur (Essigsäure - Magnesium - Reaktion)
Prinzip Die Geschwindigkeit einer chemischen Reaktion wird stark von der Temperatur beeinflusst. Durch die Umsetzung von Magnesium mit Essigsäure bei verschiedenen Temperaturen und Messen der dabei jeweils pro Zeiteinheit gebildeten Mengen an Wasserstoff lässt sich dies gut zeigen. Ein Vergleich der Anfangsgeschwindigkeiten der Reaktionen zeigt in erster Näherung etwa eine Verdopplung der Reaktionsgeschwindigkeit bei einer Temperaturerhöhung um 10 K. Vorteile • Didaktisch anschauliche Einführung in die Kinetik chemischer Reaktionen • Gefährdungsbeurteilung verfügbar - einfache und schnelle Versuchsvorbereitung
CHF 4’520.95
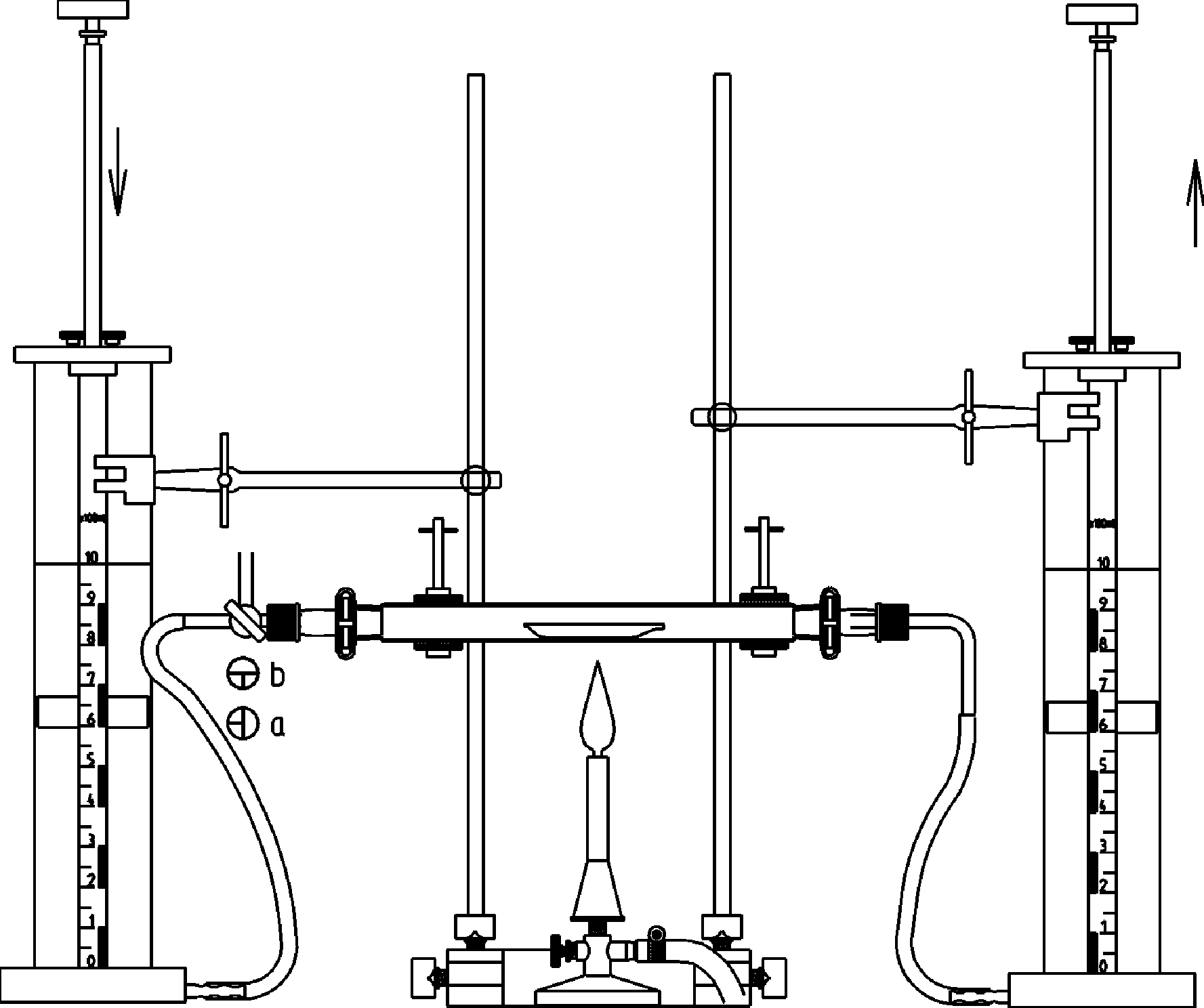
Bestimmung der molaren Massen von Metallen
Prinzip Die molare Masse [M] bildet sich aus dem Quotienten der Masse [m] und der Stoffmenge [n] eines Stoffes (M=m/n) und wird üblicherweise in g/mol angegeben. Im Versuche wird in den Einsatz des Reaktionszylinders ein abgewogenes Stück Metall gegeben und der Zylinder über den Dreiwegehahn mit einer Säure etwa bis zur Hälfte gefüllt. Durch Absenken des Einsatzes bringt man das Metall mit der Säure zur Reaktion und fängt den entstehenden Wasserstoff in der angeschlossenen Gasspritze auf. Aus der Masse des Metalls und dem Volumen des entstandenen Wasserstoffs erhält man die gesuchte Molmasse. Die Reaktion kann auch dazu genutzt werden, die Wertigkeit des Metalls zu bestimmen. Vorteile • Schnelle und einfache Versuchsvorbereitung (Versuchsanleitung und Gefährdungsbeurteilung verfügbar) • Übersichtlicher Aufbau auf der Hafttafel und anschauliche Versuchsdurchführung • Versuchsaufbau auch zur Bestimmungung der Molmasse weiterer Metalle geeignet
CHF 1’796.60
Das Gesetz der festen Massenverhältnisse bei chemischen Reaktionen - quantitative Untersuchungen zu Oxiden und Sulfiden
Prinzip Das Gesetz der festen Massenverhältnisse lautet: "Chemische Verbindungen setzen sich aus den Elementen nach festen Massenverhältnissen zusammen. Entdecker dieses Gesetzes war Joseph Louis Proust (1754-1826). Der Nachweis dieses Gesetzes wird im ersten Versuch durch quantitative Verfolgung der Synthese von Metallsulfiden, im zweiten und dritten Versuch dagegen durch Reduktionen von Metalloxiden geführt. Vorteile • Experimentierliteratur für Schüler und Lehrer erhältlich: Minimale Vorbereitungszeit • Gefährdungsbeurteilung für Schüler und Lehrer erhältlich • Einfaches Lehren und effizientes Lernen beim Einsatz der verfügbaren interaktiven Experimentier-Literatur
CHF 7’595.90
Das Gesetz von der Erhaltung der Masse bei chemischen Reaktionen
Prinzip Die experimentelle Bestätigung des Gesetzes vom Erhalt der Masse kann durch die Fällung von Calciumcarbonat im Gefäß nach Landolt erfolgen. Die beiden Lösungen mit den Ausgangsprodukten werden getrennt voneinander in die beiden Schenkel des Gefäßes eingefüllt, das Gefäß wird verschlossen und gewogen. Durch Kippen des Gefäßes werden die Lösungen gemischt und eine Fällungsreaktion kann beobachtet werden. Dabei kommt es zu keiner Veränderung der Masse, wie sich durch erneutes Wägen leicht feststellen lässt. Vorteile • Didaktisch anschauliche Einführung in das Prinzip der Massenerhaltung bei chemischen Reaktionen • Experimentierliteratur für Schüler und Lehrer erhältlich: Minimale Vorbereitungszeit • Gefährdungsbeurteilung für Schüler und Lehrer erhältlich • Einfaches Lehren und effizientes Lernen beim Einsatz der verfügbaren interaktiven Experimentier-Literatur
CHF 8’576.90
Dissoziationskonstanten
Prinzip Der Farbindikator Thymolblau liegt als schwache Säure in wäßriger Lösung teilweise dissoziiert vor, wobei nichtionisierte und ionisierte Form Absorptionsmaxima bei unterschiedlichen Wellenlängen im sichtbaren Bereich der elektromagnetischen Strahlung aufweisen. Der die Lage des Dissoziationsgleichgewichts charakterisierende Ks - bzw. pKs-Wert des Indikators kann daher vorteilhaft über photometrische Messungen im visuellen Spektralbereich ermittelt werden. Vorteile • Modernes Spektralphotometer mit Display • Spektralphotometer für viele weitere Anwendungen verwendbar • Ausführliche Bedienungsanleitung
CHF 11’009.75
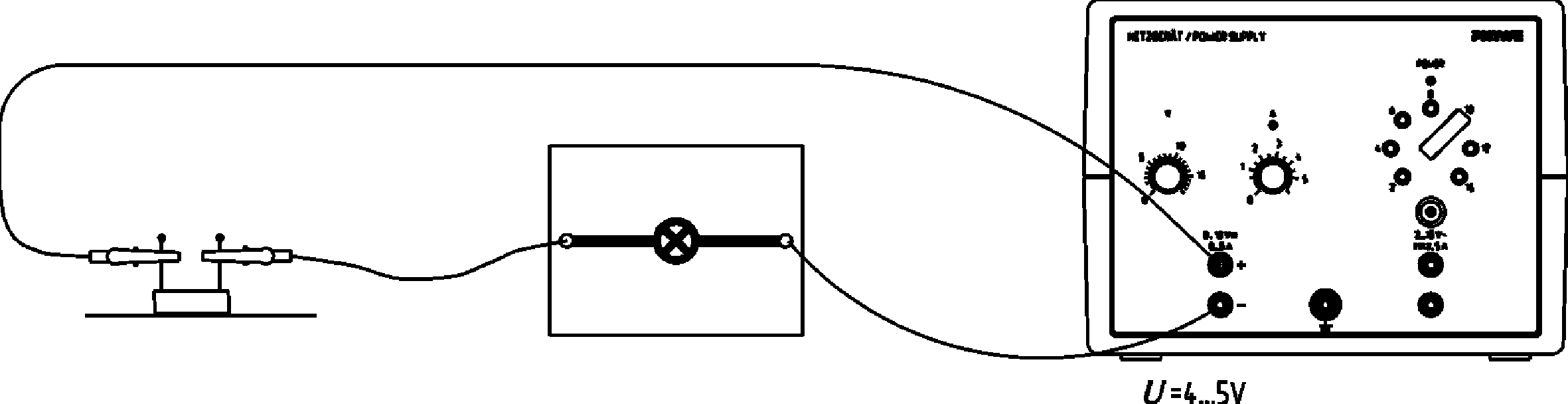
Eigenschaften von Lithium, Natrium und Kalium
Prinzip In diesem Versuch wird das Verhalten der Alkalimetalle an der Luft, sowie die Flammenfärbung bei deren Verbrennung untersucht. Die Reaktionsprodukte werden in Wasser gelöst, wobei der pH-Wert mit Hilfe des Indikators Phenolphtalein abgeschätzt wird. Abschließend wird die elektrische Leitfähigkeit der Alkalimetalle untersucht. Vorteile • Experimentierliteratur für Schüler und Lehrer erhältlich: Minimale Vorbereitungszeit • Gefährdungsbeurteilung für Schüler und Lehrer erhältlich • Einfaches Lehren und effizientes Lernen beim Einsatz der verfügbaren interaktiven Experimentier-Literatur
CHF 2’239.20
Osmose - Abhängigkeit des osmotischen Drucks von der Konzentration
Vorteile • Quantitative Bestimmung verschiedener Vorgänge bei der Osmose • Multiple Messpunkte erlauben eine detaillierte Analyse • Skalierbarer Versuche: die Anzahl der Messpunkte kann beliebig verändert werden
CHF 4’574.65
Reaktionsgeschwindigkeit und Aktivierungsenergie für die saure Hydrolyse von Essigsäureethylester
Prinzip Essigsäureethylester wird in saurer Lösung nach einem Zeitgesetz pseudo-erster Ordnung zu äquivalenten Mengen an Ethanol und Essigsäure hydrolysiert. Durch alkalimetrische Bestimmung der gebildeten Essigsäure kann auf die zeitliche Konzentration an Ester geschlossen werden. Vorteile • Thermostat für präzise Temperaturkontrolle • Stabiler und sicherer Aufbau durch solides Stativmaterial
CHF 3’488.65
Verteilungsgleichgewicht
Prinzip Bei konstanter Temperatur und konstantem Druck verteilt sich eine gelöste Substanz zwischen zwei mischbaren Flüssigkeiten in einem konstanten Konzentrationsverhältnis. Dieses Verhältnis entspricht dem Verteilungskoeffizienten (Distributionskoeffizient) der untersuchten Substanz in dem gegebenen Zweiphasensystem. Vorteile • Modernes, einfach zu bedienendes Fotospektrometer
CHF 2’769.10

























 Versuche & Sets
Versuche & Sets